En début d’infection virale, la mise en place d’interactions spécifiques et non spécifiques entre des facteurs viraux et cellulaires conditionne la progression ou l’arrêt de l’infection. En particulier, certaines voies de résistance peuvent être contournées par les virus en exprimant divers facteurs de pathogénicité. Parmi ces facteurs, certains agissent en dérégulant des voies de défense innées comme l’interférence par l’ARN (ou RNA silencing, RNAi) ou les voies de signalisations hormonales initialement mises en place pour limiter ou stopper leur progression. Nous nous intéressons aux mécanismes moléculaires impliqués dans la pathogénicité, la suppression du RNA silencing et le mouvement viral. En effet, ces fonctions virales semblent être intimement coordonnées pour parvenir à une infection efficace. Les modèles viraux étudiés sont des virus appartenant aux genres Benyvirus et Polerovirus qui se différencient par leurs stratégies d’expression, leurs mécanismes de propagation dans la plante et leurs modes de transmission vectorielle.
Etude du mouvement des polérovirus dans le phloème
Porteur de projet :Véronique ZIEGLER-GRAFF
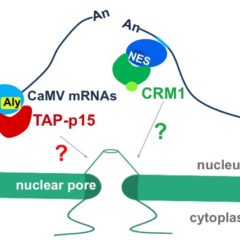
Les polérovirus se caractérisent par leur transmission obligatoire par puceron et leur tropisme phloémien. Récemment nous avons découvert une nouvelle protéine, la protéine P3a codée par un gène cryptique conservé chez les polérovirus. Cette petite protéine, exprimée à partir d’un codon d’initiation non conventionnel, est essentielle au mouvement viral à longue distance dans la plante. Nous cherchons maintenant à préciser son mode d’action, en étudiant en particulier les interactions avec les autres protéines virales nécessaires au mouvement du virus dans le phloème.